共计 2469 个字符,预计需要花费 7 分钟才能阅读完成。
近年来,随着抗体药物、基因治疗、细胞治疗等创新生物药的兴起,医学界迎来了以生物递送系统为核心的新一代治疗革命。细胞外囊泡(EVs)是由细胞释放的具有脂质双层膜结构的纳米级小囊泡,能够携带蛋白质、RNA、DNA 等生物活性分子,并通过其膜表面特性靶向特定细胞,调节细胞功能。EVs 在治疗多种疾病方面展现出巨大潜力,包括创伤性疾病、退行性疾病、急性炎症和难治性疾病。近年来,EVs 作为天然治疗药物或药物递送载体的研究逐渐增多,其低免疫原性、良好的生物相容性和多功能性使其在临床应用中具有显著优势。2025 年 6 月发表于《Signal Transduction and Targeted Therapy》的综述文章《Extracellular vesicle-based drug overview: research landscape, quality control and nonclinical evaluation strategies》,由中国国家药品监督管理局药品审评中心、吉林大学第一医院与同济大学医学院徐俊教授联合撰写,对 EV 药物的研究版图、工艺开发、质量控制和非临床评价进行了系统总结,为未来 EV 药物监管和临床转化提供了指导性框架。
一、细胞外囊泡:天然的生物信息载体
EV 是细胞分泌的具有磷脂双层膜结构的纳米颗粒,主要包括外泌体(exosomes)和微囊泡(microvesicles)。它们包裹着蛋白质、RNA、DNA 和脂质等多种活性分子,可在细胞间转运生物信号,实现跨细胞通讯。这种结构与功能特性,使 EV 既能作为自身具有治疗作用的生物制剂,也能成为药物递送载体。与传统药物相比,EV 具有诸多优势:高生物相容性与低免疫原性,避免异物反应;靶向性强、穿透力高,可跨越血脑屏障等生物屏障;不可自我复制,无肿瘤形成风险;可工程化改造,实现药物分子精准递送。EV 药物的发展兼具抗体偶联药物(ADC)的靶向性、基因治疗的递送能力,以及干细胞治疗的功能特性,具有成为下一代“多功能生物药”的潜力。
二、从天然到工程化:EV 药物研发的演进路径
EV 研究经历了从“细胞代谢废物”到“细胞通讯介质”,再到“治疗药物”的转变。作者将 EV 药物的发展分为两类:天然 EV(natural EVs)与工程化 EV(engineered EVs)。天然 EV 主要来源于细胞培养上清、体液或植物组织。根据来源,可分为:哺乳动物细胞来源 EV:以间充质干细胞(MSC)来源 EV 最具代表性,具有抗炎、免疫调节和组织修复作用,已在肺、肝、肾、皮肤、心脏及神经系统疾病等多领域进入临床前研究阶段。乳源 EV:来源广泛、稳定性高,可口服递送,显示出抗炎、抗肿瘤及组织修复潜力。植物来源 EV:来自姜、橙、卷心菜等可食植物,富含植物活性成分,成本低、免疫风险小,正在成为新兴研究热点。
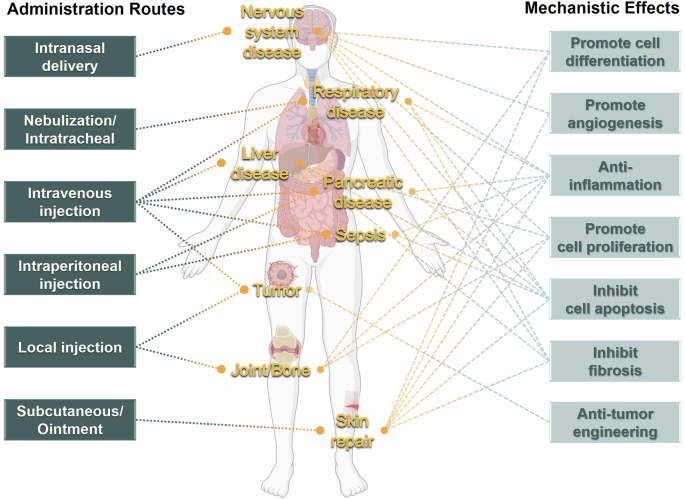
为克服天然 EV 靶向性不足、药物装载效率低等限制,研究者通过 基因工程、物理化学修饰与材料工程 等手段实现 EV 的人工改造。装载策略 包括外源装载(电穿孔、超声、冻融循环等)与内源装载(基因编辑、病毒转导等);载荷类型 可为小分子药物、蛋白质、siRNA/mRNA、miRNA 等;材料修饰 (如表面肽偶联、磁性纳米颗粒、凝胶支架)可增强组织靶向性与控释性能。例如,研究者将IL- 3 受体配体与 EV 膜蛋白融合,成功构建针对慢性髓性白血病细胞的靶向递送系统;将 狂犬病毒糖蛋白肽与 EV 融合 ,可跨越血脑屏障治疗脑损伤;此外, 微针贴片、磁性引导、凝胶缓释系统 等技术的结合,为 EV 药物局部递送提供了新的平台。
三、临床研究:从实验室到病房的跨越
截至 2025 年,全球已有超过 100 项临床研究评估 EV 药物在呼吸系统、神经系统、肿瘤及急性炎症性疾病中的疗效。文章重点概述了几大疾病领域的突破:(1)呼吸系统疾病:MSC-EVs 通过调控多种信号通路(如 PI3K/Akt、Nrf2、NF-κB 等),能抑制炎症、减少细胞凋亡、促进肺组织修复,已在急性肺损伤、特发性肺纤维化、哮喘及 COVID-19 相关 ARDS 模型中显示疗效。(2)神经系统疾病:EV 药物可促进神经元存活与再生,在脑卒中、脊髓损伤、阿尔茨海默病等中枢神经疾病中具有显著保护作用。工程化 EV 可通过特定肽段实现血脑屏障穿透,为神经退行性疾病治疗开辟新路径。(3)急性炎症与器官衰竭:MSC-EVs 可通过 lncRNA H19 或 miR-17 等分子机制调控免疫反应,缓解急性肝衰竭和胰腺炎。部分经靶向修饰的胎盘来源 EV 在动物模型中表现出显著疗效。(4)肿瘤治疗:免疫细胞来源 EV(如树突状细胞或 NK 细胞 EV)能增强抗肿瘤免疫;而工程化 EV 可装载化疗药或 siRNA,靶向递送至肿瘤细胞,减少系统毒性。例如,负载多柔比星的磁性 EV 在外场引导下实现精准肿瘤定位与局部热疗释放。
四、挑战与未来方向
尽管 EV 药物展现出巨大潜力,但其临床转化仍受限于若干关键问题:1)机制不明与标准缺失 :EV 生物学机制、分类标准及作用路径尚不完全清晰,导致实验间重复性不足。2) 规模化制备困难 :细胞培养及 EV 纯化工艺复杂,生产成本高、批次差异大。3) 质量控制体系缺位 :目前全球尚无针对 EV 药物的监管指南,产品定义、检测标准、稳定性评估等均需建立。4) 非临床安全性评估不足 :急需系统研究 EV 的免疫毒性、长期代谢及生物分布特征。作者提出,应建立 全流程质量控制与非临床评价框架,包括原料细胞鉴定、囊泡纯度与功能检测、稳定性验证以及动物药代与安全性研究。同时,亟需制定国际统一标准,促进监管科学的发展。
五、迈向下一代“先进治疗药物”
综上所述,EV 药物的发展正处于从实验室研究向临床转化的关键阶段。它代表着一种 EV 新范式——利用细胞自然分泌系统实现精准、可控、低毒的生物递送。未来,随着工程化技术与监管体系的完善,EV 有望成为继抗体药物与细胞疗法之后的第三大生物药物平台,为肿瘤、神经退行性疾病、自身免疫病及急性炎症提供全新治疗思路。细胞外囊泡药物的发展,不仅是技术的革新,更是生物医药监管科学的新挑战。唯有科学与规范并进,才能让这一‘细胞信息载体’真正走向患者。