共计 1257 个字符,预计需要花费 4 分钟才能阅读完成。
全骨髓贴壁筛选法 利用 BMSC 具有贴壁生长的特性,通过多次换液去除不贴壁的造血干细胞及其他悬浮细胞,从而达到纯化的目的。
实验动物
- 健康、清洁级大鼠,通常选择 2~4 周龄的幼年大鼠,其骨髓 BMSC 含量和增殖能力较高。
主要试剂
- 培养基:推荐使用含有 20% 胎牛血清(FBS)的 DMEM/F12 或 α -MEM 培养基。也可选用市售的专用 BMSC 完全培养基。
- 辅助试剂:
- 磷酸盐缓冲液(PBS),含双抗。
- 0.25% 胰蛋白酶(含或不含 EDTA)。
- 抗凝剂(肝素或 EDTA)。
- 双抗(青霉素 - 链霉素)。
- 75% 酒精。
主要耗材
- 注射器(1 mL、10 mL)、针头。
- 40 µm 细胞滤网。
- 离心管、培养皿 / 培养瓶。
- 眼科剪、眼科镊等。
分离步骤
- 处死大鼠:通过颈椎脱臼等安乐死方式处死大鼠,并用 75% 酒精全身消毒。
- 取材:
- 将大鼠后肢皮肤剥离,剔除肌肉和结缔组织,分离出股骨和胫骨。
- 在超净工作台内,将股骨和胫骨放入预冷的、含双抗的 PBS 中清洗。
- 获取骨髓:
- 用眼科剪剪去股骨和胫骨的两端骨骺。
- 用 1 mL 注射器抽取适量含血清和双抗的培养基,从骨髓腔的一端冲洗,将骨髓冲入含有抗凝剂的培养皿中。
- 制备细胞悬液:
- 用滴管反复吹打骨髓悬液,使其充分分散成单细胞悬液。注意动作轻柔,避免产生气泡。
- 将悬液用 40 µm 细胞滤网过滤,去除骨髓碎片和组织块。
- 接种培养:
- 收集滤液,以 1000 rpm 离心 4~6 分钟,收集细胞沉淀。
- 用完全培养基重悬细胞,根据骨髓量调整细胞密度,通常每只大鼠的后肢骨髓可接种一个 T25 培养瓶。
将细胞悬液接种于培养皿或培养瓶中,置于 37℃、5% CO2 的培养箱中培养。
培养和纯化步骤
- 首次换液:接种后 48~72 小时,首次全量换液。去除悬浮的造血细胞,保留贴壁的 BMSC。
- 后续换液:此后每 2~3 天更换一次培养基,继续去除未贴壁的细胞和漂浮的碎片。通常在首次换液后 2~7 天内,可观察到贴壁细胞形成集落。
- 传代扩增:当细胞汇合度达到 80%~90% 时,进行传代。用 PBS 清洗细胞 2 次,加入适量胰酶消化,待细胞变圆、间隙增大时,终止消化。收集细胞悬液,离心后用新培养基重悬,按 1:2 或 1:3 的比例接种到新的培养瓶中。通常在第 3 代左右,细胞形态会变得均匀,纯度较高,可用于后续实验。
关键成功因素:
取材和分离过程要迅速,尽量缩短细胞在体外无血清环境下的暴露时间。吹打力度要轻柔,避免对细胞造成损伤,影响存活率。胎牛血清(FBS)的质量对 BMSC 的生长影响很大,应选择批次稳定、经严格筛选的高品质血清。BMSC 在传代时需要维持较高的细胞密度,避免因细胞数量过少而导致生长停滞或分化。
细胞鉴定。
纯化后的 BMSC 需要通过以下方法进行鉴定,以确认其干细胞特性:
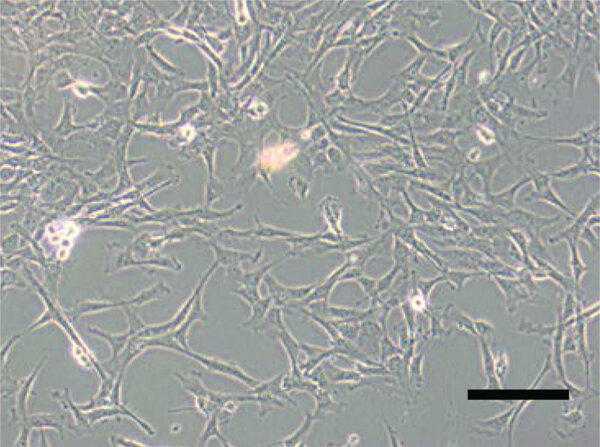
形态学观察:使用倒置相差显微镜观察,纯化的 BMSC 应呈长梭形或纤维状。流式细胞术(FCM):检测 BMSC 的表面标记物。阳性标记物包括 CD29、CD44 等,阴性标记物包括 CD34、CD45 等造血干细胞标志物。多向分化潜能:在特定诱导条件下,BMSC 可以分化为成骨细胞、成脂细胞和软骨细胞,并通过相应的染色方法(如阿利新蓝染色、油红 O 染色等)进行鉴定。
正文完
发表至: 骨髓间充质干细胞
2025-10-26